
Авелумаб у пациентов, ранее получавших лекарственную терапию с метастатической и/или неоперабельной карциномой Меркеля: обновленные данные общей выживаемости при периоде наблюдения > 5 лет
Авторы: Paul Nghiem, Shailender Bhatia, Andrew S. Brohl, Omid Hamid, Janice M. Mehnert, Patrick Terheyden, Kent C. Shih, Isaac Brownell, Celeste Lebbe, Karl D. Lewis, Gerald P. Linette, Michele Milella, Huiling Xiong, Guelseren Guezel, Sandra P. D'Angelo
Введение:
Карцинома Меркеля (КМ) - редкая и агрессивная форма рака кожи. Несмотря на то, что КМ считается химиочувствительной опухолью, эффективность химиотерапии ограничена. До одобрения ингибиторов иммунных контрольных точек пациенты с метастатической КМ (мКМ) имели плохой прогноз с историческим показателем 5-летней общей выживаемости (ОВ) примерно 14%. Авелумаб (анти-PD-L1) стал первым одобренным препаратом для лечения пациентов с мКМ, основываясь на данных эффективности и безопасности II фазы исследования JAVELIN Merkel 200 (NCT02155647), в котором пациенты с мКМ получали монотерапию авелумабом. Далее приводятся данные общей выживаемости при долгосрочном наблюдении для когорты пациентов с мКМ, заболевание которых прогрессировало после ≥1 линии предшествующей химиотерапии.
Методы:
Пациенты соответствовавшие критериям включения имели гистологически подтвержденный диагноз мКМ при наличии измеряемых очагов (согласно RECIST 1.1). Пациенты получали авелумаб в дозе 10 мг / кг внутривенно каждые 2 недели до подтверждения прогрессирования заболевания, неприемлемой токсичности или отмены. Была проанализирована долговременная ОВ. Обновленные данные для других конечных точек эффективности, включая ответ и выживаемость без прогрессирования, не были получены.
Результаты:
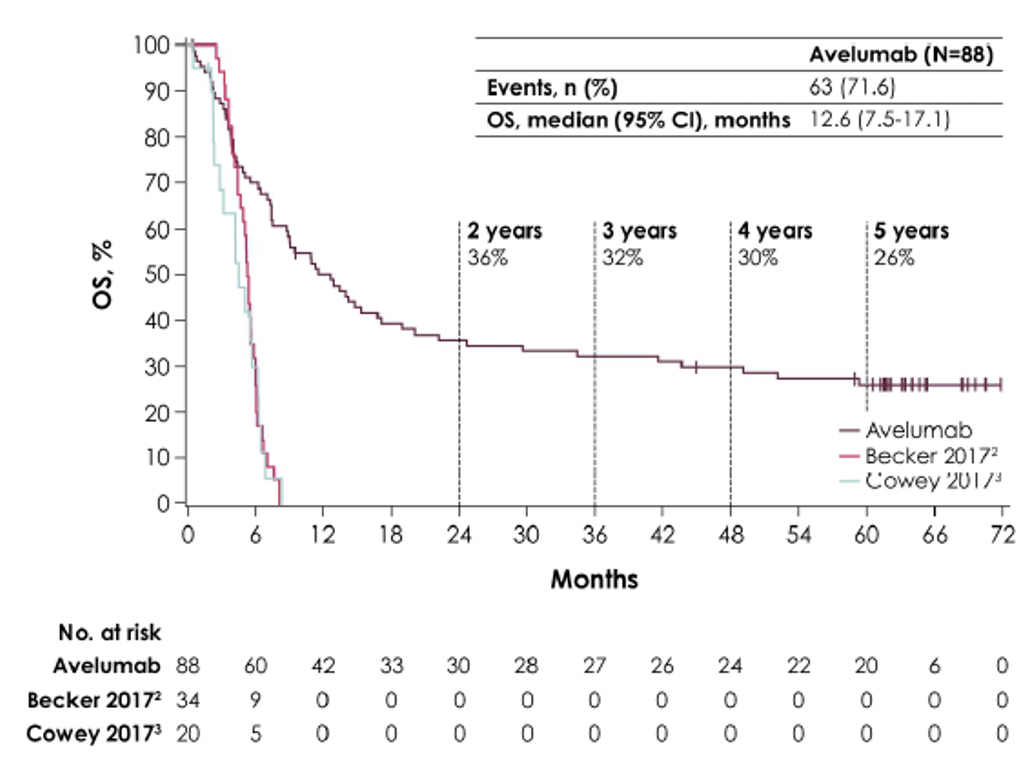
Всего в исследование было включено 88 пациентов, которые получали терапию авелумабом. По состоянию на 25 сентября 2020 г. (срез данных) медиана наблюдения составила 65,1 месяца (60,8-74,1 месяца). Медиана ОВ составила 12,6 месяцев (95% ДИ, 7,5-17,1 месяца); показатели 48-мес. и 60-мес. ОВ составили 30% (95% ДИ, 20-40%) и 26% (95% ДИ, 17%-36%), соответственно. На момент среза данных лечение продолжалось у 1 пациента (1,1%), а еще одному пациенту (1,1%) был повторно назначен авелумаб после прекращения лечения ранее. Причинами прекращения лечения были прогрессирование заболевания (n = 45 [51,1%]), нежелательное явление (НЯ; n = 11 [12,5%]), летальный исход (n = 10 [11,4%]), отзыв согласия (n = 9 [ 10,2%]), отказ от последующего наблюдения (n = 1 [1,1%]), несоблюдение протокола (n = 1 [1,1%]) и другие причины (n = 10 [11,4%]). На момент среза данных 19 пациентов (21,6%) прекратили лечение, но оставались на последующем наблюдении, а 63 пациента (71,6%) умерли; причинами смерти были прогрессирование заболевания (n = 49 [55,7%]), неизвестная причина (n = 9 [10,2%]), НЯ, не связанные с исследуемым лечением (n = 3 [3,4%]), и другие причины (n = 2 [2,3%]). Всего 26 пациентов (29,5%) получили последующую противоопухолевую терапию. Наиболее частыми видами терапии после прекращения исследования были авелумаб (n = 4 [4,5%]), карбоплатин и этопозид (n = 4 [4,5%]) и пембролизумаб (n = 4 [4,5%]).
Выводы:
Монотерапия авелумабом привела к значимому увеличению общей выживаемости в подгруппе пациентов с мКМ, заболевание которых прогрессировало после ≥1 линии предшествующей химиотерапии. Эти результаты дополнительно подтверждают роль авелумаба в качестве стандарта терапии пациентов с метастатической карциномой Меркеля. Информация о клиническом исследовании: NCT02155647 (https://clinicaltrials.gov/ct2/show/NCT02155647)
RU-AVEMCC-00011
Рис. 1. Общая выживаемость среди всех пациентов в исследовании по сравнению с историческими данными для химиотерапии.
Краткая инструкция БАВЕНСИО®
РУ: ЛП–005886
МНН: Авелумаб.
Лекарственная форма: концентрат для приготовления раствора для инфузий. Состав. 1 флакон содержит действующее вещество: авелумаб 200,0 мг, вспомогательные вещества: D–маннитол, ледяная уксусная кислота, полисорбат 20, натрия гидроксид, вода для инъекций.
Показания к применению: Монотерапия у взрослых ранее леченных пациентов с метастатической карциномой Меркеля (МКМ); В комбинации с акситинибом в качестве терапии первой линии при распространенном почечно-клеточном раке у взрослых; В качестве монотерапии для поддерживающей терапии первой линии взрослых пациентов с местнораспространенной или метастатической уротелиальной карциномой (УК), заболевание которых не прогрессировало при индукционной химиотерапии первой линии на основе платины.
Противопоказания. Гиперчувствительность к препарату БАВЕНСИО® или любому компоненту препарата в анамнезе; Детский возраст до 18 лет; Нарушение функции почек и печени тяжелой степени тяжести.
Способ применения и дозы. Терапия должна назначаться и контролироваться врачом, имеющим опыт лечения онкологических заболеваний.тРекомендуемая доза препарата БАВЕНСИО® при монотерапии составляет 800 мг внутривенно в течение 60 минут каждые 2 недели. Применение препарата БАВЕНСИО® следует продолжать в соответствии с рекомендуемой схемой до прогрессирования заболевания или возникновения неприемлемых токсических эффектов. Рекомендуемая доза в комбинации с препаратом акситиниб - 800 мг препарата БАВЕНСИО® внутривенно в течение 60 минут каждые 2 недели и 5 мг препарата акситиниб внутрь 2 раза в сутки (с интервалом между приемами 12 часов) вне зависимости от приема пищи, до прогрессирования заболевания или возникновения неприемлемых токсических эффектов. Для получения информации о способе применения и дозе акситиниба – смотри инструкцию по применению акситиниба. Премедикация. Перед первыми 4 инфузиями препарата БАВЕНСИО® пациенту следует провести премедикацию антигистаминными средствами и парацетамолом. Если четвертая инфузия завершается без развития инфузионных реакций, премедикация перед введением последующих доз назначается по усмотрению врача. Коррекция дозы. Повышение или снижение дозы препарата БАВЕНСИО® не рекомендуется. С учетом индивидуальной безопасности и переносимости возможна задержка введения очередной дозы препарата или прерывание лечения.
Побочное действие. НР у пациентов, получавших терапию препаратом БАВЕНСИО® в ходе клинических исследований. Cледующие побочные явления отмечались часто (≥1 % и <10 %) и очень часто (≥10 %): Нарушения со стороны крови и лимфатической системы - Очень часто анемия, часто лимфопения, тромбоцитопения, нечасто эозинофилия. Нарушения со стороны иммунной системы – нечасто Реакция гиперчувствительности, лекарственная реакция гиперчувствительности, редко анафилактическая реакция, реакция гиперчувствительности I типа. Нарушения со стороны эндокринной системы – часто гипотиреоз, гипертиреоз, нечасто надпочечниковая недостаточность, аутоиммунный гипотиреоз, тиреоидит, аутоиммунный тиреоидит, редко Острая недостаточность коры надпочечников*, недостаточность функции гипофиза. Нарушения со стороны обмена веществ и питания – очень часто снижение аппетита, часто гипонатриемия, нечасто гипергликемия,редко сахарный диабет, сахарный диабет 1 типа. Нарушения со стороны нервной системы – часто головная боль, головокружение, периферическая нейропатия, нечасто головная боль, головокружение, периферическая нейропатия, редко синдром Гийена-Барре, синдром Миллера-Фишера . Нарушения со стороны сердечно–сосудистой системы, часто гипертензия, нечасто гиперемия кожи, гипотензия, редко миокардит . Нарушения со стороны дыхательной системы, органов грудной клетки и средостения – очень часто кашель, одышка, часто пневмонит, редко интерстициальная болезнь лёгких . Нарушения со стороны желудочно–кишечного тракта – очень часто Тошнота, диарея, запор, рвота, боль в животе, часто колит, кишечная непроходимость, редко панкреатит, аутоиммунный колит, энтероколит, аутоиммунный панкреатит, энтерит, проктит. Нарушения со стороны печени и желчевыводящих путей – нечасто аутоимунный гепатит, редко острая печеночная недостаточность, печеночная недостаточность, гепатит, гепатотоксичность . Реакции со стороны кожи или подкожных тканей – часто сыпь, зуд, макулопапулезная сыпь, сухость кожи, нечасто экзема, дерматит, зудящая зудящая сыпь, псориаз, сыпь, эритематозная сыпь, эритема, генерализованная сыпь, пятнистая сыпь, папулезная сыпь, редко мультиформная эритема, гемморагическая сыпь, витилиго, генерализованный зуд, эксфолиативный дерматит, пемфигоид, псориазоподобный дерматит, медикаментозная сыпь, красный плоский лишай . Нарушения со стороны костно–мышечной и соединительной ткани – очень часто, боль в спине, артралгия, часто миалгия, нечасто миозит, ревматоидный артрит, редко артрит, полиартрит, олигоартрит. Нарушения со стороны почек и мочевыводящих путей – нечасто Ппочечная недостаточность, нефрит, редко тубулоинтерстициальный нефрит. Общие расстройства и нарушения в месте введения – очень часто утомляемость, повышение температуры тела, периферические отеки, часто Астения, озноб, гриппоподобное заболевание, редко Синдром системной воспалительной реакции. Влияние на результаты лабораторных и инструментальных исследований –очень часто снижение массы тела, повышение уровней АСТ, АЛТ, часто Повышение активности гамма-глутамилтрансферазы, щелочной фосфатазы, амилазы, липазы, концентрации креатинина крови, нечасто повышение активности аспартатаминотрансферазы (АСТ), аланинаминотрансферазы (АЛТ), креатинфосфокиназы, редко повышение активности трансаминаз, снижение свободного тироксина, повышение тиреостимулирующего гормона в крови. Травмы, интоксикации и осложнения манипуляции –очень часто инфузионные реакции. Инфекции и инвазиинечасто пустулезная сыпь
Особые указания. Инфузионные реакции. У пациентов, получающих препарат БАВЕНСИО®, были зарегистрированы инфузионные реакции, часть из которых были тяжелыми. У пациентов следует контролировать появление симптомов и признаков инфузионных реакций, в том числе повышения температуры тела, озноба, покраснения кожи, снижения артериального давления, одышки, свистящего дыхания, боли в спине, боли в животе и сыпи. При развитии инфузионных реакций 3–ей и 4–ой степени тяжести следует прекратить инфузию и отменить препарат БАВЕНСИО®. Иммуноопосредованные реакции. Большинство иммуноопосредованных нежелательных реакций на фоне приема препарата БАВЕНСИО® были обратимыми и прекращались после кратковременного или длительного прерывания терапии препаратом БАВЕНСИО®, применения кортикостероидов и/или поддерживающей терапии.
Ознакомьтесь с полной информацией в инструкции по применению лекарственного препарата для медицинского применения Бавенсио®. Претензии потребителей и информацию о нежелательных явлениях следует направлять по адресу: ООО «Мерк», 115054, г. Москва, ул. Валовая, д. 35 , Тел.: +7(495) 937 33 04, Факс: +7(495) 937 33 05, e–mail: safety@merck.ru
(Variation № 3 29.07.2021 SmPC ver 20 June 2019. (CCDS 5.0)).



